
Los experimentos técnicos simples son muy útiles para hacer con niños, esto es pasar tiempo juntos, inculcar habilidades y comprensión por parte de pequeños diseñadores, lo básico, que los panes, como en la famosa caricatura, no crecen en los árboles.
Esta vez, decidimos hacer la fuente química de corriente más simple e intentar aplicarla para cualquier cosa práctica. Hablando de la aplicación práctica, vale la pena recordar que hace unas pocas generaciones, los radioaficionados, para suministrar sus receptores y amplificadores de radio de batería, se les ofreció fabricar varios tipos de células galvánicas o baterías para producción independiente. Estos son los elementos de Leklanshe y Popov [1] p. 9 ... 18, o una batería de plomo-potasa o gas [1], p. 22 ... 28. Varios elementos de corriente relativamente alta se conectaron a una batería incandescente (filamento incandescente de tubos de radio), docenas de elementos más pequeños, a una batería anódica, cuyo voltaje podría alcanzar 60-80 voltios. Las baterías estaban "húmedas", con electrolito líquido y requerían cuidado y mantenimiento.
Entonces célula galvánica, unas pocas palabras "¿cómo?" y "¿por qué?" La corriente eléctrica ocurre cuando los metales interactúan. En este caso, se produce una diferencia de potencial diferente (voltaje). En 1793, Alessandro Volta, al construir una celda galvánica (polo Volta), estableció la actividad relativa de los metales conocidos en ese momento: Zn, Pb, Sn, Fe, Cu, Ag, Au. La "resistencia" de la celda galvánica resultó ser mayor, cuanto más separados estaban los metales en esta fila (la serie de voltajes).

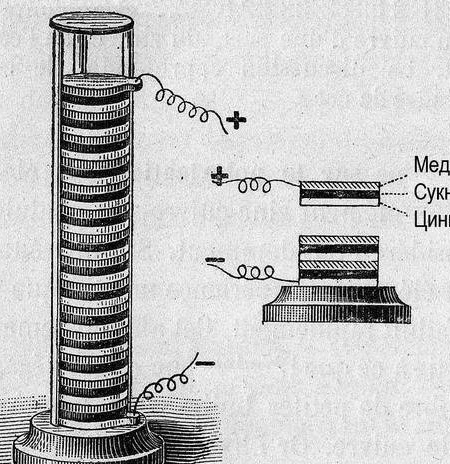
Más tarde, para organizar los datos, se tomó como referencia cero el potencial del "electrodo de hidrógeno". Después de medir el potencial de los metales emparejados con él, los metales experimentales se organizaron en una fila. La tabla resultante se llamó "Serie Electroquímica de Estrés Metálico" y en el gabinete de química, debe colgar al lado del sistema periódico y el retrato de Dmitry Ivanovich.
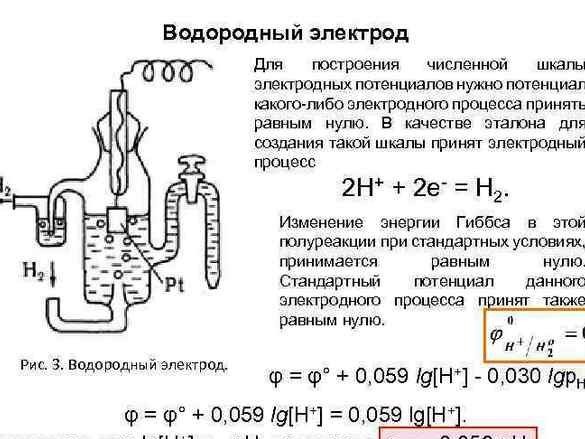

Una serie de tensiones metálicas son un artilugio útil, en nuestro caso, nosotros, como Alessandro Volta, lo sabremos: cuanto más se separen los metales entre sí, mayor será la tensión obtenida.
En nuestros experimentos, como los clásicos, utilizamos cobre y zinc.Cuando las placas se sumergen en un electrolito, entre esta y la placa de zinc, se produce una reacción química, como resultado de lo cual se acumulan cargas negativas en la placa y se carga negativamente. Como resultado de la reacción que tiene lugar en la celda galvánica, el electrodo de zinc se disuelve gradualmente.
En un electrodo de cobre, durante la operación de una celda galvánica, se forman pequeñas burbujas de hidrógeno que aíslan la superficie de cobre del electrolito. El fenómeno se llama, en una celda galvánica es dañino, están luchando con él. Para eliminar el hidrógeno liberado, se introducen sustancias llamadas hidrógeno en el electrolito. En su papel a menudo se encuentran compuestos de manganeso, sulfato de cobre. En experimentos simples, se puede usar permanganato de potasio de farmacia.
Lo que usamos para el experimento.
Dispositivos y materiales.
Para el ensamblaje de celdas galvánicas, como electrodos de cobre, puede usar alambre, alambre, papel de aluminio. El zinc se puede extraer de elementos secos, se pueden utilizar productos galvanizados. En lugar de zinc, puede intentar usar un electrodo de aluminio o hierro. Cloruro de sodio para electrolitos, un poco de alambre de montaje blando. Definitivamente necesita un voltímetro o multímetro, cortadores de alambre, tijeras. Como recipientes, se pueden usar recipientes no metálicos de un tamaño adecuado. Vidrio, más conveniente que los vasos de plástico livianos: son más pesados, más estables y más difíciles de volcar. Es muy bueno si hay una carga de baja tensión y baja corriente: una radio simple, un reloj de cuarzo, etc.
Batería de "alto voltaje" de alambre y tornillos.
Fascinado por la simplicidad de los detalles y el voltaje relativamente alto recibido, tratamos de armar una batería de este tipo. Aquí se usa un par de metales "clásicos", cobre-zinc. La idea es usar sujetadores galvanizados como electrodo de zinc. Con gracia. Está claro que dicho elemento no está diseñado para una operación a largo plazo: una capa delgada de zinc se disolverá rápidamente, sin embargo, esto no es importante para un experimento a corto plazo. Pero los tornillos o dientes galvanizados están llenos en todas partes.
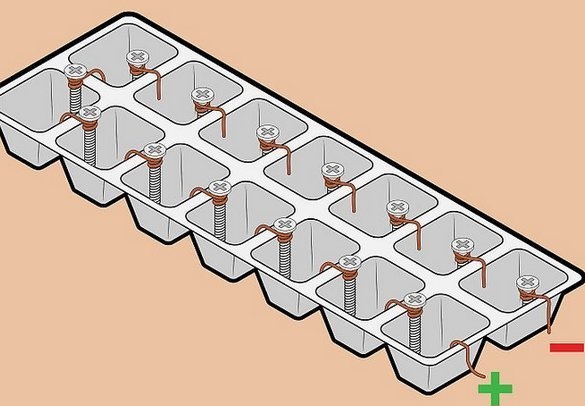
También se usa un cable como electrodo de cobre, también un material ampliamente disponible, además, la instalación más conveniente de elementos en una batería, todos los elementos están conectados en serie, más uno al menos del siguiente. En este caso, el voltaje se suma, la corriente permanece igual.
Empecemos
Después de seleccionar el número requerido de sujetadores galvanizados de la longitud deseada, encontramos un cable de cobre adecuado. Este es un alambre sinuoso en aislamiento de barniz. El diámetro del cable es de aproximadamente 0,5 mm.

Pole limpia el aislamiento del barniz, varias veces, con esfuerzo tirando del alambre a través de una piel de pulido de doble tamaño de tamaño mediano.


Luego, prepara un par de electrodos: debajo de la cabeza de un tornillo autorroscante, envuelve firmemente dos o tres vueltas de cable y corta el exceso.

Montaje de la batería: se usó un recipiente como contenedor para congelar el hielo. Puede usar celdas de dulces en caja, sin embargo, son más sutiles. Después de instalar los electrodos en las paredes entre las celdas, llenamos los recipientes con electrolitos. Utilizamos una solución de sal de mesa, una cucharada con un portaobjetos de 0,5 litros de agua tibia. Para el llenado es muy conveniente usar una jeringa médica.


Encontramos algunos tornillos más para electrodos y elementos añadidos a la batería, eso es lo que obtuvimos. El voltaje a una carga de alta impedancia (resistencia de entrada de un voltímetro digital) es considerable, pero a cualquier carga, por notable que sea, cae significativamente.
Intenta hacer Celda galvánica similar (batería) con electrodos más grandes.
Como contenedor, utilizamos un frasco de medio litro (dos), caben platos de un área considerable. Como electrodos, tomamos una lámina delgada de cobre y zinc, los restos de un vidrio de un elemento "seco" de fábrica, desmontados durante la producción de grafito para recubrimiento refractario.

Limpiamos los restos de sales cristalinas secas con un cepillo de alambre y cortamos dos placas con unas tijeras aproximadamente con aproximadamente la misma área. De papel de cobre, corte dos franjas a juego. También con tijeras. Tenemos dos pares de electrodos, que equiparon nuestros elementos, sin más preámbulos, doblando sus bordes en el cuello de la lata.


En un recipiente más grande, prepararon un electrolito: cloruro de sodio, disuelto en agua tibia, la concentración es la misma y se vierten los elementos preparados.


Conectamos los dos elementos en serie, usando una pieza del cable de montaje y dos pinzas de cocodrilo. Entonces, bien, el voltaje de la batería está cerca del "dedo" estándar, intente usarlo. Se usa un elemento con un voltaje de 1.5 V en un reloj electromecánico, además, el consumo de corriente del reloj es muy pequeño y nuestra batería podrá sobrecargarlo.

Quitamos la batería estándar del reloj y conectamos a los terminales una pieza del cable de montaje. Observando la polaridad (placa de cobre - "+", zinc - "-"), conectó nuestro reloj a una batería improvisada, ¡listo! El reloj funciona, el voltaje se "hunde" a 1.3 V. El reloj funcionó perfectamente durante varias horas, hasta que todos nos jactamos (¡sin embargo un brujo!) Luego nos cansamos.

A la pista.
La constitución interna de cualquier niño es tal que la atención en un tema, es capaz de concentrarse no más de 15 ... 20 minutos, y todas las clases con niños deben planificarse para que encajen en ese momento, o cambiar entre diferentes clases, de lo contrario, ambos serán atormentados.
Como carga, es mejor aplicar eso ya sea en movimiento o luminoso: los números en el voltímetro impresionan la mente, pero no el corazón. Además de los relojes y las calculadoras, ciertamente causará admiración, el trabajo de una batería casera de un pequeño receptor de radio (como opción, ¡uno hecho en casa!).
Para un uso a largo plazo, el electrolito de las células debe protegerse del polvo y la evaporación, y cuidar el despolarizador, bueno, al menos obstruir el frasco con un trozo de película de plástico con una banda elástica y agregar permanganato de potasio al electrolito. Además, es mejor recopilar inmediatamente el elemento mencionado de Popov.
Además de los tornillos autorroscantes galvanizados, es posible utilizar chapa de acero galvanizado, para elementos grandes es más conveniente: durante el experimento, puede obtener una corriente y potencia significativas (moviendo los dedos en el aire).
Lista de literatura utilizada.
1. P. Strelkov. Conocer y poder Pionero ingeniero eléctrico. Detgiz 1960 año
2. V.S. Polosin, V.G. Prokopenko. Taller sobre la metodología de la enseñanza de la química. Moscú, "Ilustración", 1989, pp. 202,203.

