Saludos los habitantes de nuestro sitio!
De año en año, la producción de petróleo se está volviendo cada vez más compleja y el combustible que se obtiene es cada vez más caro. En los países de la UE, generalmente amenazan con dejar de producir motores de gasolina, quieren reemplazar todos los vehículos con autos eléctricos. Pero las baterías de litio aún están lejos de ser ideales, y por cierto, no tienen prisa por convertirse en ideales. En el mejor de los casos, con una sola carga de una batería de litio, será posible cubrir una distancia de un máximo de 700 km, después de lo cual tendrá que cargar la batería durante aproximadamente una semana, y si usa una toma de corriente normal para cargar, generalmente toma mucho tiempo. Y solo imagina lo que sucederá si todos comienzan a cargar constantemente sus autos eléctricos, qué cargas enormes en la red eléctrica serán y cuánto voltaje se descargará. En general, el futuro de las baterías de litio sigue siendo bastante vago y cada año se dedica más y más investigación a la búsqueda de nuevas opciones de baterías.
Como saben, el metal que consume más energía es el aluminio. Ya en nuestro tiempo con algunos prototipos de baterías de aluminio, puede conducir unos 2000 km sin recargar, y la recarga de este tipo de batería lleva solo 15 minutos, después de lo cual puede ir más allá durante unos 2000 km.
La recarga de baterías de aluminio difiere de la recarga de baterías a base de litio. Sin embargo, no hay nada complicado, solo necesita insertar un nuevo aluminio, verter el electrolito y verter un nuevo electrolito, todo es esencialmente lo mismo que la gasolina un carro, solo que este es un automóvil eléctrico, y no hay cargas en la red eléctrica. Además, no necesita producir una gran cantidad de enchufes con cables con una sección transversal enorme para cargar todos estos autos eléctricos.
Pero no todo es tan fácil aquí. Obtener electricidad del aluminio no es tan fácil como nos gustaría. Primero, descubramos cuál es el principio de la batería de aluminio y aire.
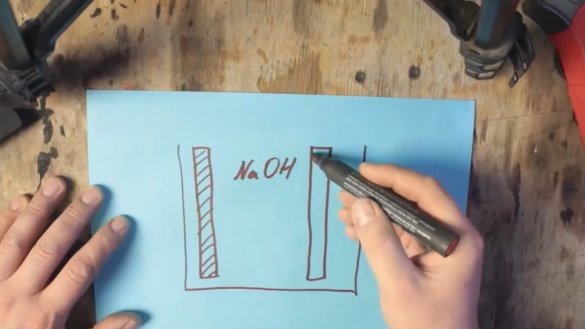
Para que dicha batería comience a funcionar, se necesitarán 2 electrodos: uno natural de aluminio y el segundo de grafito. Ambos electrodos están en una solución electrolítica.
La sal (NaCl) se puede usar como electrolito, pero con ella puede elevar el voltaje a aproximadamente 0.7V. El voltaje del electrolito alcalino (NaOH) se puede aumentar aún más, a aproximadamente 1V.
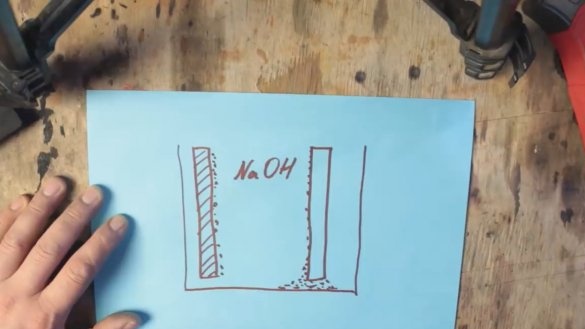
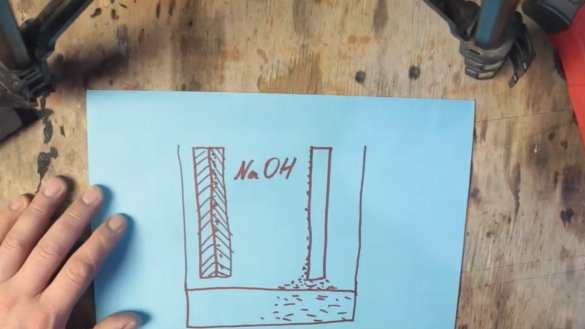
Durante la reacción química, el aluminio se recubre con una capa de hidróxido de aluminio (Al (OH) 3), que se hunde gradualmente hasta el fondo del tanque. Y en la superficie del electrodo de grafito se forman burbujas de hidrógeno, que a su vez conducen a un aumento de la resistencia y una caída de voltaje, este proceso se llama polarización.
El primer problema con la precipitación del hidróxido de aluminio puede eliminarse simplemente aumentando la capacidad donde se asentará el producto gastado, pero el segundo problema puede ser ayudado por una masa despolarizante basada en óxido de manganeso, que se convertirá en hidróxido de manganeso durante la operación.
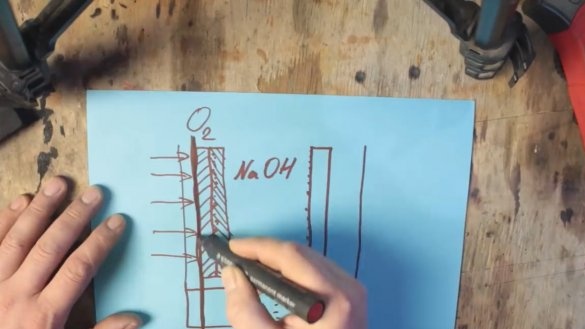
De hecho, tenemos una batería alcalina ordinaria, pero solo una muy grande. Pero surge un nuevo problema. El hecho es que el óxido de manganeso también se consume y también tendrá que ser cambiado. Y debemos asegurarnos de que solo se gaste el aluminio. Para hacer esto, tome oxígeno del aire circundante. Aquí es donde comienza la batería de aluminio y aire. Una de las paredes solo necesita ser reemplazada por una membrana permeable a los gases, y el electrodo de grafito debe ser reemplazado por una mezcla de grafito y óxido de manganeso con nanopartículas de platino o plata.
El óxido de manganeso con nanopartículas de metales nobles no reacciona, pero actúa como un catalizador, debido a lo cual el hidrógeno del electrolito es oxidado por el oxígeno en el aire.
La tecnología para producir óxido de manganeso con inclusiones de nanopartículas de plata no es complicada en principio y puede probarse en condiciones artesanales. Pero en este artículo discutiremos cómo hacer la opción más económica para una batería que recibe energía del aluminio. Las siguientes instrucciones se han tomado del canal de televisión Fiery YouTube. Más detalles en el video original del autor:
La versión de presupuesto máximo de grafito son los insertos de contacto de verano para los trolebuses. Puede encontrarlos completamente gratis en las paradas finales de trolebús, o puede comprarlos, no son caros, el autor los encontró a la venta a 22 rublos cada uno.
A continuación, necesitamos un álcali. Aquí hay una herramienta para limpiar tuberías en su composición contiene cien por ciento de álcali de sodio.
Para comenzar la reacción alcalina, solo necesitamos un poco, 1 g de álcali por 0.5 l de agua será suficiente.
En primer lugar, verifiquemos si realmente se necesita un electrodo de grafito en esta batería. Por experiencia, tomemos este electrodo de acero inoxidable.
Ahora colocamos la placa de aluminio y el electrodo de acero inoxidable en el álcali, conectamos el multímetro y vemos cuántos voltios resulta.
Como puede ver, resultó ser aproximadamente 1.4V. Ahora verifiquemos la corriente de cortocircuito.
La corriente de cortocircuito resultó en la región de 20 mA. Qué conclusiones se pueden sacar: teóricamente en condiciones extremas es posible ensamblar una batería de tazas de acero inoxidable y papel de aluminio.
A continuación tendremos un electrodo de cobre hecho de cobre eléctrico.
Como podemos observar, el voltaje resultó ser ligeramente superior a 1.4V, pero la corriente de cortocircuito fue al principio alta, pero luego comenzó a ceder bastante rápido y el cobre también comenzó a cubrirse con una capa oscura, muy probablemente este efecto fue causado por impurezas en el agua, ya que En este experimento, el autor le dio un toque a un toque.
Ahora sumerja el electrodo de grafito en la solución electrolítica.
Con este electrodo, se obtuvo un voltaje de 1.3 V, la corriente de cortocircuito se detuvo en la región de 17 mA. A primera vista, parece que el electrodo de acero inoxidable es más eficiente, pero la superficie del electrodo de acero inoxidable es más grande, por lo que aún no se sabe qué grafito o acero inoxidable es mejor.
Dado que el grafito tiene una resistencia bastante grande, debe lidiar con él de alguna manera. Es necesario hacer electrodos a partir de un material que sea bien conductor, y el grafito solo debe estar en su superficie.Se decidió perforar a través del grafito, y en los agujeros resultantes cortar la rosca para los pernos m6.
El resultado es un electrodo de acero con una carcasa de grafito.
La resistencia del grafito no perforado es de aproximadamente 4,5 ohmios, pero la del grafito perforado es de aproximadamente 1,7 ohmios.
En la cara, una disminución en la resistencia y, en consecuencia, la efectividad de la estructura aumentará. En otros experimentos, utilizaremos agua destilada.
El primer experimento con un electrolito, en el que 4 g de álcali por 1 litro de agua.
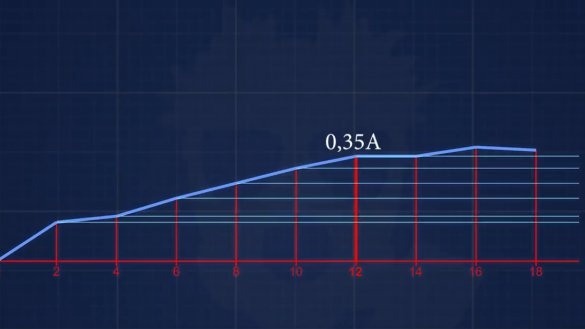
La corriente de cortocircuito resultó 150mA. El siguiente electrolito tiene una concentración de 6 g de álcali por 1 litro. Bueno, y así sucesivamente, cada vez aumentaremos la concentración en 2 g hasta que alcancemos una concentración en la que la corriente no aumentará.
Aunque una batería tan simple no tiene una gran eficiencia de corriente, puede funcionar durante mucho tiempo y cualquier aluminio puede usarse como electrodos, que pueden fundirse fácilmente en electrodos de cualquier forma, por ejemplo, latas de aluminio. Varias bebidas alcohólicas y no alcohólicas, papel de chocolate, etc.
Como resultado, después de todos los experimentos con diferentes concentraciones de electrolitos, queda claro que con este diseño de la batería no tiene sentido agregar más de 12 g de álcali a 1 litro de agua, es decir, obtenemos aproximadamente 1% de solución.
Luego, el autor ensambló otro clip, que consta de 3 electrodos.
Dos baterías dan un voltaje más alto y menos pérdida, por lo que el resultado es mejor.
Ahora, tomemos un balde de electrolito, una gran pieza de aluminio y 2 electrodos de acero inoxidable.
En un cubo, una concentración de electrolitos de 10g / 1l. Corriente pico 1.3A, se hundió a 520mA. Con toda el área enorme de acero inoxidable, no se compara con el grafito, porque resultó ser 600mA con grafito. Por cierto, el hidrógeno se libera durante la reacción, que también se puede recoger y utilizar como fuente de energía. En resumen, hay espacio para crecer. Eso es todo por ahora. Gracias por su atencion Hasta pronto!